Temas de investigación
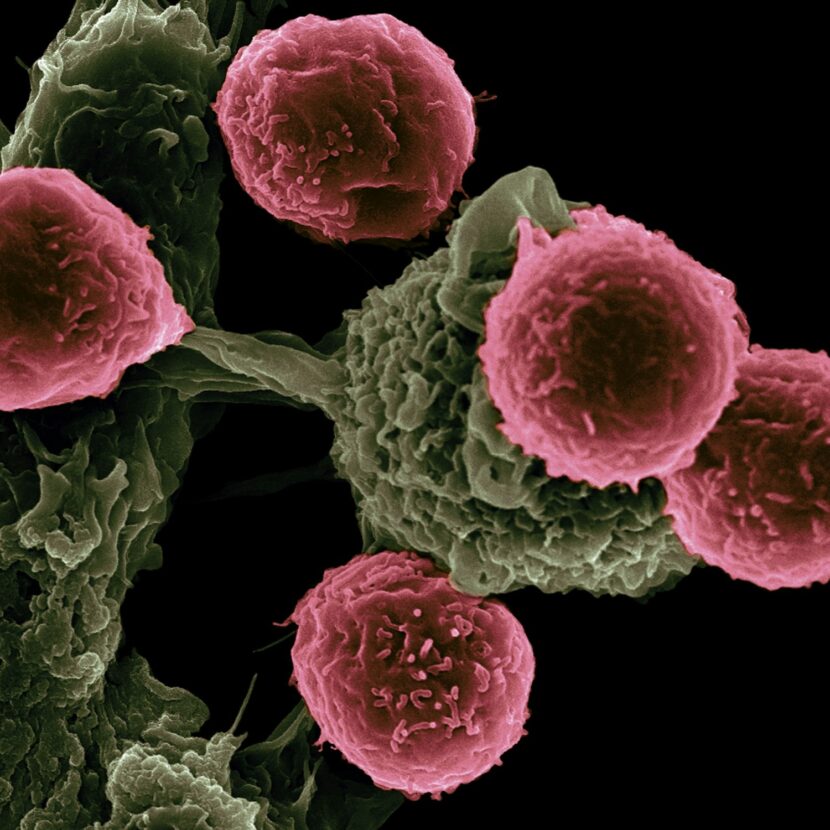
Nuestro laboratorio estudia los mecanismos de transducción de señales de las células inmunitarias y sigue el comportamiento de los leucocitos en la salud y la enfermedad. En concreto, estudiamos los mecanismos moleculares que regulan la respuesta inmunitaria de las células T y Natural Killer (NK), con el objetivo de modular su estado de activación y respuesta en condiciones fisiopatológicas, incluido el cáncer. Las células NK proporcionan la primera línea de defensa inmunitaria contra las infecciones virales y el crecimiento tumoral. Su actividad está controlada por el equilibrio entre las señales mediadas por receptores activadores frente a los inhibidores expresados en su superficie celular; la ligadura de estos receptores dicta el comportamiento de las células NK, lo que resulta en citotoxicidad dirigida a las células cancerosas o dotación de autotolerancia. Para llevar a cabo nuestra investigación, aplicamos técnicas multidisciplinares, que incluyen ingeniería molecular, nanobiología, enfoques bioquímicos y biofísicos, silenciamiento génico mediante tecnología CRISPR, uso de organoides y sistemas de modelos murinos in vivo. Además, nuestros estudios utilizan técnicas avanzadas de microscopía (imágenes de células vivas, FRET) y citometría de flujo espectral.
Reprogramación de células NK disfuncionales
Las células asesinas naturales disfuncionales pueden reprogramarse para recuperar la actividad antitumoral EMBO Molecular Medicine 2024
Las células asesinas naturales (NK) son fundamentales para el sistema inmunitario innato, ya que reconocen antígenos sin sensibilización previa y contribuyen al control y la eliminación de infecciones virales y cáncer. Sin embargo, una proporción significativa de células NK en ratones y humanos no expresan receptores inhibidores clásicos durante su proceso de educación y se vuelven naturalmente «anérgicas», es decir, exhiben funciones efectoras reducidas. Los eventos moleculares que conducen a la anergia de las células NK, así como su relación con los subyacentes al agotamiento de las células NK que surge de la sobreestimulación en enfermedades crónicas, siguen siendo desconocidos. Aquí, caracterizamos el fenotipo «anérgico» y demostramos similitudes funcionales, transcripcionales y fenotípicas con el estado «agotado» en las células NK infiltrantes de tumores. Además, identificamos el factor de transcripción Egr2 y la diacilglicerol quinasa DGKα como reguladores negativos comunes que controlan la disfunción de las células NK. Por último, los experimentos en un modelo de cultivo de esferoides organotípicos en 3D y un modelo tumoral in vivo sugieren que una plataforma de administración basada en nanopartículas puede reprogramar estas poblaciones disfuncionales de células asesinas naturales en su microambiente nativo. Este enfoque puede llegar a ser clínicamente relevante para el desarrollo de nuevas estrategias inmunoterapéuticas antitumorales.
Puedes leer toda la investigación aquí